Тестирование на наличие герминальных мутаций в генах BRCA1/2 в лечебной тактике онкологических больных
Сакаева Д.Д. ФГБОУ ВО БГМУ МИНЗДРАВА РОССИИ
Необходимо как для выявления и дальнейшего наблюдения за здоровыми носителями в семьях, так и для изменения лечебной тактики у самих пациенток с РМЖ, а именно для раннего выявления у пациенток раков другой локализации, возможного проведения профилактических операций, изменения схем химиотерапии и индивидуализации терапии с помощью таргетных препаратов. (Suspitsin E/ Hered Cancer Clin Pract2009 Feb 25;7(1):5. doi: 10.1186/1897-4287-7-5)
Неоадъювантная терапия:
BRCA-ассоциированный РМЖ обладает характерными особенностями, отличающими его от других вариантов РМЖ. Этот вариант РМЖ особенно чувствителен к химиотерапии производными платины. В 2010 году было опубликовано ретроспективное исследование из Польши. При ретроспективном анализе базы данных больных РМЖ были выявлены 102 пациентки-носительницы мутаций BRCA-1, которые получили различные режимы неоадъювантной химиотерапии. Всего из 102 больных полный лечебный патоморфоз был получен в 24% случаев. При этом на фоне неоадъювантной химиотерапии цисплатином частота полного лечебного патоморфоза была в несколько раз выше, чем при терапии другими режимами химиотерапии: при лечении по схеме CMF – в 7%, АТ – в 8%, AC или FAC – в 22%, цисплатином – в 83% случаев (у 10 из 12 больных). (Byrski T, et al. J Clin Oncol 2010;28:375)
Особенностью BRCA1-ассоциированного РМЖ является также высокая чувствительность к другим режимам химиотерапии. Так, в исследовании неоадъювантной химиотерапии антрациклин-таксановыми режимами у больных BRCA1-ассоциированным РМЖ полный лечебный патоморфоз наблюдали в 2 раза чаще по сравнению с пациентками без мутаций BRCA1 (46% против 22%). (Arun et al., JCO 2011;29:3739-3746)
В рамках крупного исследования GeparSixto анализировались частота pCR и безрецидивная выживаемость у больных ТНРМЖ (n=291) в зависимости от включения карбоплатина в режимы неоадъювантной химиотерапии (НАХТ), статуса мутации в гене BRCA и наличия нарушений в системе гомологичной рекомбинации ДНК (Annals of Oncology 29: 2341-2347, 2018 doi:10.1093/annonc/mdy460 Published online 18 October 2018). Пациенты были рандомизированы в группу, получавшую паклитаксел+непегилированный липосомальный доксорубицин (РМ) и группу, получавшую данную комбинацию плюс карбоплатин (РМСb). Вторичными конечными точками были выживаемость без прогрессирования 9ВБП) и общая выживаемость (ОВ). Медиана длительности наблюдения составила 47.3 месяцев. Определение дефицита гомологичной рекомбинации (HRD) было одной из эксплораторных точек исследования и было успешно проведено в образцах формалин-фиксированной опухолевой ткани у 193/315 (61.3%) пациенток с ТНРМЖ. Дефицит гомологичной рекомбинации определялся по шкале HRD score при показателе более 42 баллов и/или наличии в опухоли мутаций в генах BRCA (tmBRCA). Мутации в гене BRCA1/2 были выявлены у 17,2% (50 из 291) больных.
При первом анализе были получены следующие результаты: добавление карбоплатина обеспечивало статичтически значимое преимущество в общей когорте пациенток с ТНРМЖ по показателю ППО, при этом среди пациенток с наличием мутаций в генах BRCA наблюдалось более высокая чатсота достижения ППО вне зависимости от варианта терапии (с или без добавления карбоплатина).
Таблица 2. Частота полного лечебного патоморфоза (pCR) исследование GeparSixto)
| Подгруппа | pCR в группе с карбоплатином | pCR в группе без добавления карбоплатина | ОР, 95% ДИ, p |
| В общей группе ТНРМЖ | 56,8% (83 из 146) | 41,4% (60 из 145) | ОР 1,87; 95% ДИ 1,17-2,97; p=0,009 |
| BRCA+ | 65,4% (17 из 26) | 66,7% (16 из 24) | |
| ТНРМЖ без BRCA мутаций | 55% (66 из 120) | 36,4% (44 из 121) | ОР 2,14; 95% ДИ 1,28-3,58; р=0,004 |
В более позднем анализе получено статистически значимое преимущество по показателю выживаемость без признаков заболевания (DFS) (ОР 0.56, 95% ДИ 0.34-0.93; P ¼ 0.022) в группе с карбоплатином. Преимущество по ОВ не достигло статистической значимости. Добавление карбоплатина не давало статистически значимого преимущества по выживаемости без признаков заболевания и общей выживаемости в подгруппе HER2-позитивных опухолей. HRD был диагностирован у 136 (70.5%) из 193 ТНРМЖ, из которых у 82 (60.3%) было высокое значение HRD score в отсутствие мутаций BRCA. HRD был независимым предиктором полного патоморфологического ответа (ППО) [OR 2.60, 95% ДИ 1.26-5.37, P ¼ 0.008]. Добавление карбоплатина статистически увеличивало частоту достижения ППО с 33.9% до 63.5% у пациентов с HRD (P ¼ 0.001), но преимущество у пациентов с отсутствием дефицита гомологичной рекомбинации было на границе статистической значимости (повышение с 20.0% до 29.6%, P ¼ 0.540; тест на взаимодействие P ¼ 0.327). Так же частота ППО в группе с карбоплатином была выше (63.2%) у пациенток с HRD в отсутствие мутаций в генах BRCA, чем без добавления карбоплатина (31.7%; OR 3.69, 1.46-9.37, P ¼ 0.005). Улучшение по показателю выживаемость без признаков заболевания при добавлении карбоплатина в схему неоадъювантной терапии было получено как для опухолей с отсутствием HRD (hazard ratio 0.44, 0.17-1.17, P ¼ 0.086), так и для опухолей с дефицитом гомологичной рекомбинации (hazard ratio 0.49, 0.23-1.04, P ¼ 0.059).
Таблица 3. Подгрупповой анализ исследования GeparSixto. Предикторы полного патоморфологического ответа.
| ППО (ypT0 ypN0) | Всего | Без карбоплатина | С карбоплатином | ||||
| N | N (%, 95% CI) | N | N (%, 95% CI) | N | N (%, 95% CI) | ||
| Отсутствие HRD | 57 | 14 (24.6, 13.4-35.7) | 30 | 6 (20.0, 5.7-34.3) | 27 | 8 (29.6,12.4-46.9) | |
| HRD+ | 136 | 68 (50.0, 41.6-58.4) | 62 | 21 (33.9, 22.1-45.7) | 74 | 47 (63.5, 52.5-74.5) | |
| OR* 3.071 (95% CI 1.540-6.126), p<0.001 | |||||||
| HRD и BRCA мутация | 54 | 31 (57.4, 44.2-70.6) | 21 | 8 (38.1, 17.55-46.0) | 33 | 23 (69.7, 54.0-85.4) | |
| HRD score более 42/отсутствие BRCA мутации | 79 | 37 (46.8, 35.8-57.8) | 41 | 13 (31.7, 17.5-46.0) | 38 | 24 (63.2, 47.8-78.5) | |
| OR** 1.530 (95% CI 0.762-3.073), p=0.230 | |||||||
| ППО (ypT0/is ypN0) | |||||||
| Отсутствие HRD | 57 | 17 (29.8, 17.9-41.7) | 30 | 6 (20.0, 5.7-34.3) | 27 | 11 (40.7, 22.2-59.3) | |
| HRD+ | 136 | 76 (55.9, 47.5-64.2) | 62 | 28 (45.2, 32.8-57.5) | 74 | 48 (64.9, 54.0-75.7) | |
| OR* 2.980 (95% CI 1.539-5.771) p<0.001 | |||||||
| HRD и BRCA мутация | 54 | 37 (68.5, 56.1-80.9) | 21 | 13 (61.9, 41.1-82.7) | 33 | 24 (72.7, 57.5-87.9) | |
| HRD score более 42/отсутствие BRCA мутации | 79 | 39 (49.4, 38.3-60.4) | 41 | 15 (36.6, 21.8-51.3) | 38 | 24 (63.2, 47.8-78.5) | |
| OR** 2.232 (95% CI 1.082-4.604), p=0.027 | |||||||
Возвращаясь к повышенной чувствительности BRCA-ассоциированного рака молочной железы к производным платины, последние были исследованы не только в качестве неоадъювантной терапии, но и в терапии метастатического рака молочной железы. В исследовании III фазы TNT исследовали химиотерапию карбоплатином по сравнению с доцетакселом при метастатическом РМЖ. Включали только пациенток с тройным негативным РМЖ или пациенток с любым вариантом РМЖ, но имеющих мутации генов BRCA. Всего было включено 376 пациенток, из них 43 имели мутации BRCA (31 BRCA1 и 12 BRCA2). Не было получено значительной разницы по частоте объективного ответа (ЧОО) в общей популяции пациенток (ЧОО 59/188 (31·4%)в сравнении с 64/188 (34·0%), абсолютная разница -2·6%, (95% ДИ 12·1 - 6·9), p=0·66). У пациенток с мутациями BRCA наблюдали противоположную картину: объективный ответ на фоне карбоплатина составил 68%, а на фоне доцетаксела – лишь 33,3% (абсолютная разница 34,7%, р=0,03). Аналогичные различия наблюдались и в выживаемости без прогрессирования. У пациенток без мутаций BRCA1/2 медиана ВБП на фоне карбоплатина составила 3,1 мес (95% ДИ 2,4-4,2) и в группе доцетаксела - 4,4 мес (95% ДИ 4,1-5,1). У пациенток с мутациями BRCA1/2, напротив, медиана ВБП на фоне карбоплатина оказалась больше, чем на фоне доцетаксела: 6,8 мес по сравнению с 4,4 мес (р=0,002). Таким образом, у пациенток с мутациями BRCA карбоплатин оказался эффективнее по сравнению с доцетакселом. Медиана ОВ в общей популяции составила 12,8 месяцев (95% ДИ 10,6-15,3) и 12месяцев (95% ДИ 10,2-13,0) для группы карбоплатина и доцетаксела соответственно. Так же, как и для ВБП, для ОВ не было получено данных о значительных различиях между группами- абсолютная разница составила 0,03 месяца (p=0·96). Однако и в группе пациенток с мутациями BRCA1/2, не было получено различий в общей выживаемости, которые можно объяснить кроссовером. У пациенток с возможностью провести секвенирование образцов опухолевой ткани и выявленными мутациями BRCA1/2 было выявлено преимущество в ЧОО при терапии карбоплатином по сравнению с доцетакселом (ЧОО 12/18 (66·7%) против 5/14 (35·7%), абсолютная разница 31·0%, p=0·15)в то время как преимущество доцетаксела было характерно для подгруппы с диким типом (ЧОО 23/90 (25·6%) против 32/90 (35·6%), абсолютная разница -10·0%, p=0·20). Эксплораторный анализ оценивающий влияние BRCA1 метилирования или низкого уровня мРНК не выявил каких-либо данных, которые бы свидетельствовали в пользу ранее выдвигаемой теории о взаимосвязи этих показателей с более высоким ответом на карбоплатин по сравнению с доцетакселом. Было обнаружено, что большинство пациенток с наличием мутаций в генах BRCA ½ или метилированием BRCA1 имеют высокий HRD Score, однако пациентки с высоким уровнем HRD Score” в отличие от пациенток с мутациями не имели преимущества по ЧОО от терапии карбоплатином по сравнению с доцетакселом (ЧОО 13/34 (38.2%) vs. 19/47 (40.4%), абсолютная разница 2.2%, p=1.0) В дополнение к этим данным, оказалось что пациентки с высоким HRD score имели численно большее значение ЧОО на оба варианта терапии, хотя различия не достигли статистической значимости.
Одно из новых направлений лекарственной терапии РМЖ- это персонализированная терапия (PARP-ингибиторы). В 2017 году были опубликованы результаты первого крупного исследований III фазы, оценивающего эффективность и безопасность PARP-ингибитора олапариба (таблетки по 300 мг 2 р/сут) в сравнении с терапией по выбору врача при метастатическом HER-2 негативном РМЖ с наличием герминальных мутаций в гене BRCA 1/2. Первичной конечной точкой была ВБП, по независимой оценке, вторичные конечные точки включали ОВ, ЧОО, ВБП2, безопасность и переносимость. В данном исследовании была достгнута перичная конечная точка, олапариб статистически значимо увеличивал время до прогрессирования в сравнении с ТВВ. Медиана ВБП на фоне лечения олапарибом была на 69% выше по сравнению с применением стандартной химиотерапии и составила 7,0 vs 4,4 мес (ОР = 0,58, 95 % ДИ (0,43, 0,80),p=0,0009). Удвоение частоты объективных ответов (ЧОО) в группе олапариба по сравнению с ТВВ является еще одним подтверждением результатов по ВБП. В настоящее время продолжаются исследования как ранних, так и II/III фаз, изучающих эффективность монотерапии различными PARP-ингибиторами (олапариб, талазопариб, нирапариб и др.) при раке молочной железы. ( Robson et al. N Engl J Med. 2017)
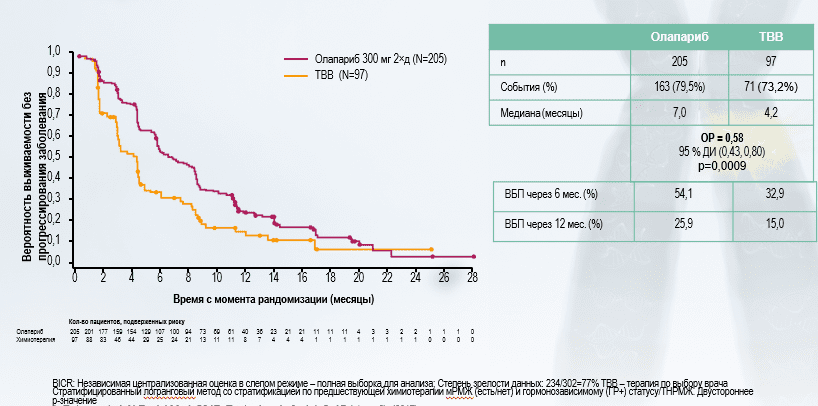
Таблица 4. Результаты по эффективности в исследовании OLYMPIAD.
| Олапариб | Терапия по выбору врача | |
| Популяция больных с возможностью оценки ответа, n | 167 | 66 |
| ЧОО, n (%) | 100 (59,9) | 19 (28,8) |
| Полный ответ, n (%) | 15 (9,0) | 1 (1,5) |
| Частичный ответ, n (%) | 85 (51,0) | 18 (27,3) |
| Медиана продолжительности ответа, месяцы (95% ДИ) | 6,4 (2,9-9,7) | 7,1 (3,2-12,2) |
| Медиана времени до наступления ответа, дни | 47 | 45 |
Кроме монотерапии таргетными препаратами изучаются различные комбинации, в том числе и с ингибиторами иммунных контрольных точек. Обоснованием для изучения таких комбинаций является гипотеза о том, что хотя в целом РМЖ- неиммуногенное заболевание, отдельные подтипы РМЖ (ТНРМЖ), и особенно варианты с наличием мутаций в генах репарации ДНК (как BRCA 1и 2), характеризуются увеличением геномной нестабильности, эекспрессией на поверхности клетки большого количества неоантигенов и повышенной иммуногенности. Двойное воздействие с помощью PARP-ингибиторов и блокаторов иммунных контрольных точек может привести к взаимному усилению эффекта. Одними их первых опубликованных данных являются предварительные результаты исследования MEDIOLA, в котором изучается эффективность и безопасность комбинации олапариба и анти PD-L1 препарата дурвалумаб при различных типах опухолей (BRCA-ассоциированный РМЖ, РЯ, рак желудка и мелкоклеточный рак легкого). В декабре 2017 года в Сан-Антонио были доложены первые результаты в когорте пациенток HER2 отр., метастатическим РМЖ с наличием герминальных мутаций BRCA, которые продемонстрировали наличие клинической эффективности и достаточно хорошей переносимости данной комбинации (ЧОО-52%, медианы ВБП и ОВ не достингуты, 12-недельная длительность клинического ответа наблюдалась у 80% пациенток, клиническая эффективность данной комбинации не зависела от статуса гормональных рецепторов, типа мутации BRCA и наличия препаратов платины в предшествующих режимах терапии, профиль и частота НЯ соответствовали предыдущим исследованием, изучавшим олапариб и дурвалумаб). В настоящее время исследование продолжается. (San Antonio Breast Cancer Symposium, December 5-9, 2017 Domchek SM Poster (PD6-11))
Таблица 5. Текущие исследования, изучающие эффективность и безопасность ПАРП-ингибиторов в монотерапии и в комбинациях.