Профилактические операции у больных раком молочной железы и у здоровых носителей наследственных мутаций
ФГБОУ ДПО филиал РМАНПО «КГМА»,
Дружков О.Б. к.м.н. доц. каф. онкологии, радиологии и паллиативной медицины
Дружков М.О., к.м.н. асс.каф. онкологии, радиологии и паллиативной медицины
В последние годы в научной среде все чаще обсуждаются профилактические операции не только при раке молочной железы и раке яичников, но и у здоровых носителей наследственных мутаций. С каждым годом онкологами все чаще выполняются мастэктомии и сальпингооварэктомии не только пациентам по поводу злокачественного новообразования, но и здоровым носителям наследственных мутаций [1][19][28].
В 2014 году общероссийским союзом общественных объединений ассоциацией онкологов России утверждены клинические рекомендации по диагностике и лечению больных раком молочной железы.
Для профилактики развития РМЖ у здоровых женщин рекомендована двухсторонняя мастэктомия. Показанием к данной операции служит заключение генетика с установлением риска развития РМЖ выше популяционного (включая мутации BRCA1 и BRCA2). Двусторонняя профилактическая мастэктомия снижает вероятность развития рака на 90-100% и может быть выполнена здоровым женщинам как с первичной реконструкцией молочных желёз, так и без.
Для профилактики развития рака контралатеральной молочной железы у больных односторонним раком показана профилактическая мастэктомия, когда риск развития РМЖ по заключению генетика превышает популяционный (включая мутации генов BRCA1 и BRCA2). Мастэктомия снижает вероятность развития второго рака на 90-100% и может быть выполнена больным односторонним РМЖ как с первичной реконструкцией молочных желёз, так и без.
И для здоровых носителей, и для пациентов с РМЖ обязательно проведение гистологического исследования удалённых тканей, при обнаружении рака лечебную тактику определяют в соответствии с морфологическими и биологическими характеристиками болезни.
По данным Heemskerk-Gerritsenetal [16] при сравнении показателей заболеваемости РМЖ у женщин после двухсторонней профилактической мастэктомии и носительниц наследственных мутаций, находящимся под пристальным наблюдением онколога, получили следующие результаты. У последнихчастота развития РМЖ составила 28 случаев на 1000 человек в год наблюдения, в то время как после профилактической мастэктомии этот показатель равнялся нулю. По результатам проспективного исследования Domcheketal [4] 7% здоровых женщин, выбравших активное наблюдение, заболели РМЖ, в то время как мастэктомия привела к полному снижению риска данной патологии. При сравнении заболеваемости РЯ у пациенток, подвергшихся профилактической овариэктомии и здоровыми носителями наследственных мутаций еще раз подтвердило необходимость такого подхода. В этом исследовании частота [4] развития РЯ у здоровых BRCA1/2- носительниц после овариэктомии составил 1%, без операции - 6%. Смертность от РМЖ или РЯ составляла 3% в случае профилактической овариэктомии и 10% без нее. В многочисленных исследованиях была доказана необходимость профилактических операций при раке молочной железы и яичников ввиду значительного снижения риска [12][8][9][26].
Стало известно, что для носительниц мутаций в генах BRCA2 профилактическая оварэктомия применяется не только для снижения риска развития рака яичников, но и снижает риск рака молочной железы в связи со снижением влияния на ткани молочных желез эстрогенов, в то время как подобная операция у женщин с мутацией BRCA1 не влияет на риск РМЖ [22]. Это связано с тем, что BRCA1-ассоциированные РМЖ редко экспрессируют рецепторы эстрогенов. Для сравнения BRCA2-ассоциированные опухоли чаще оказываются люминальным подтипом. Кроме того целый ряд исследований, подтвердил профилактический эффект тамоксифена в отношении BRCA-ассоциированных РМЖ [15]. Однако, данное влияние не исследовалось у здоровых носительниц наследственных мутаций.
В мировой онкологической практике доказано проведение профилактических операций – двусторонних мастэктомии и сальпинго-овариэктомии, которые снижают и заболеваемость, и смертность от РМЖ и РЯ [23][30]. Профилактическая мастэктомия исключительно эффективна, она снижает риск развития РМЖ на 90-95% [16]. Двусторонняя сальпинго-овариэктомия снижает риск развития РЯ, рака фаллопиевых труб, первичного перитонеального рака и РМЖ. Она особенно показана носительницам мутаций в генах BRCA1 или BRCA2 по окончании репродуктивного периода (оптимальный возраст – 35-40 лет), т. к. эффективные методы скрининга РЯ пока не разработаны [4][16]. К сожалению, в Российской федерации проведение таких операций на сегодняшний день не разрешено.
Выполнение органосохраняющих операций пациентам с раком молочной железы и/или раком яичников с мутациями в генах BRCA1 и BRCA2 сопряжено с повышенным риском развития ипсилатерального локального рецидива, а также контралатеральных опухолей молочных желез по сравнению с пациентками из общей популяции – 39 и 7%, соответственно [26].
При обнаружении мутации в гене BRCA1 или BRCA2 при РМЖ и/или РЯ Ассоциацией онкологов России было рекомендовано во-первых рассмотреть возможность проведения контралатеральной мастэктомии и двусторонней сальпинго-овариэктомии; во-вторых учесть возможность использования специализированных препаратов для таргетной терапии при РМЖ и РЯ (PARP-ингибиторов: олапариба, велипариба и других); В третьих обсудить возможность проведения генетического тестирования с целью выявления герминальной мутации в гене BRCA1 или BRCA2 у совершеннолетних родственников I степени родства.
При выявлении мутаций здоровые носители должны проходить обследование по специальной программе, которая включает самообследование молочных желез один раз в месяц с 18 лет; с 18 лет консультации гинеколога и маммолога один раз в 6 месяцев; Начиная с 25 лет проводится маммография в сочетании с МРТ молочных желёз один раз в год. После 30 лет каждые 6 месяцев необходимо проведение трансвагинального УЗИ органов малого таза (возможно, в сочетании с допплерографией) в сочетании с определением уровня опухолеассоциированного антигена СА-125.
Реконструктивно-пластические операции при раке молочной железы.
До настоящего времени по поводу рака молочной железы местно-распростаненных форм золотым стандартом считается стандартные радикальные мастэктомии по-Пейти или Маддену (полное удаление молочной железы с подмышечной лимфатической диссекцией различных уровней радикальности). Возможность выполнения органосохраняющей операции зависит от стадии заболевания, локализации опухоли, размера молочной железы, мультицентричностью. На более поздних стадиях проведение органосохраняющих операций возможно только после неоадьювантного лечения.
Для пациентов с наследственными мутациями существует ряд особенностей хирургического лечения, связанных с риском развития локальных рецидивов. Так выполнение органосохраняющих операций для таких пациентов не рекомендовано [22][15]. Обязательным условием для пациентов с мутациями в генах BRCA1/2 является выполнение радикальной мастэктомии, что приводит к снижению качества жизни ввиду утраты органа. Улучшение качества жизни больных РМЖ достигается в результате применения реконструктивно-пластических операций. Методика выполнения реконструкции зависит от многих факторов: стадии заболевания, гистотипа опухоли предшествующего лечения, особенностями тканей и телосложения пациентки и др.
Все реконструктивно-пластические операции можно разделить на одномоментные, когда за один раз выполняется удаление молочной железы вместе с ее восстановлением, и отсроченные, когда спустя какое-то время после мастэктомии проводится операция по восстановлению утраченной молочной железы (Демидов, В.П., Пак Д.Д., Евтягин В.В., 1993; Блохин С.Н., 1996; Блохин С.Н., Портной С.М., Лактионов К.П., Коптеева И.П., 1997; Noone R.B., Frazier T.G., Hayward C.Z. et al., 1982; Stevens L., McGrath M., et al., 1984; Johnson).
Существует множество способов восстановления молочной железы. Аллопластика – реконструкция с помощью эндопротезов (Radovan С., 1982; Rigotti G., Marchi А., 2002; Toth В. A., Daane S. Р., 2003). Аутопластика – реконструкция с помощью собственных тканей (с или без использования силиконовых эндопротезов) Пластика кожно-мышечным лоскутом на сосудистой ножке (несвободное перемещение донорского участка поворотом с живота, спины на зону будующей молочной железы). Существует множество различных комбинаций: реконструкцция торакодорзальным лоскутом и имплантатом, реконструкция лоскутом прямой мышцы живота (TRAM), перенос свободных лоскутов с наложением сосудистых анастомозов (микрореконструктивная операция, когда лоскут полностью отделяется от донорской зоны и под микроскопом накладываются швы между сосудами лоскута и близлежащими сосудами — торакодорзальной группой, внутренней грудной), реконструкция DIEP-лоскутом (Maliniac J.W., 1953; Hartrampf C.R., Noel R.T., 1994; Slavin S.A., Love S.M., Goldwyn R.M.,1994; Hidalgo).
Варианты реконструктивно-пластических операций при раке молочной железы:
- Модифицированная подкожная мастэктомия по-Пейти или Маддену (с сохранением сосково-ареолярного комплекса) с одномоментной установкой силиконового импланта или эндопротеза Becker.

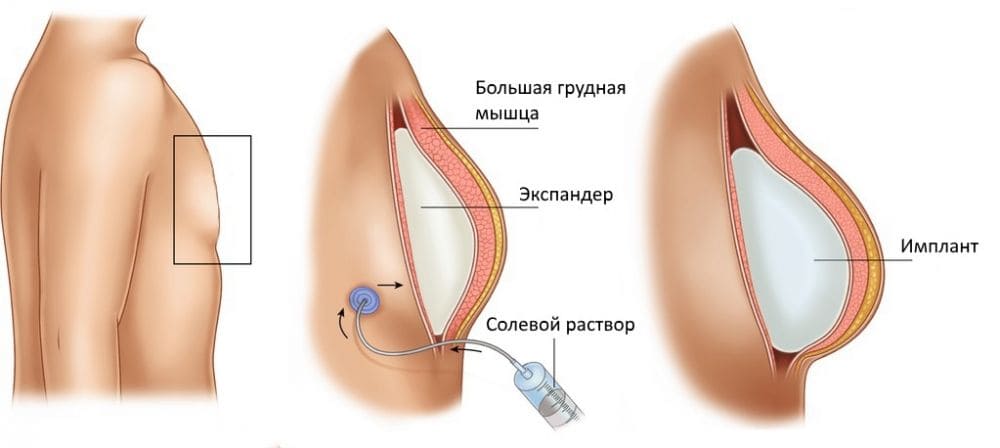
Данная методика выполняется сразу после удаления молочной железы с сохранением кожи и сосково-ареоллярного комплекса. Основным условием для применения метода реконструкции молочной железы с помощью экспандера и/или имплантата является наличие достаточного количества кожи и мышц грудной клетки (большой грудной мышцы, зубчатой мышцы) для формирования ложа для имплантата.
- Модифицированная мастэктомия по-Пейти с отсроченной установкой тканевого экспандера или эндопротеза Becker и восстановлением сосково-ареолярного комплекса.

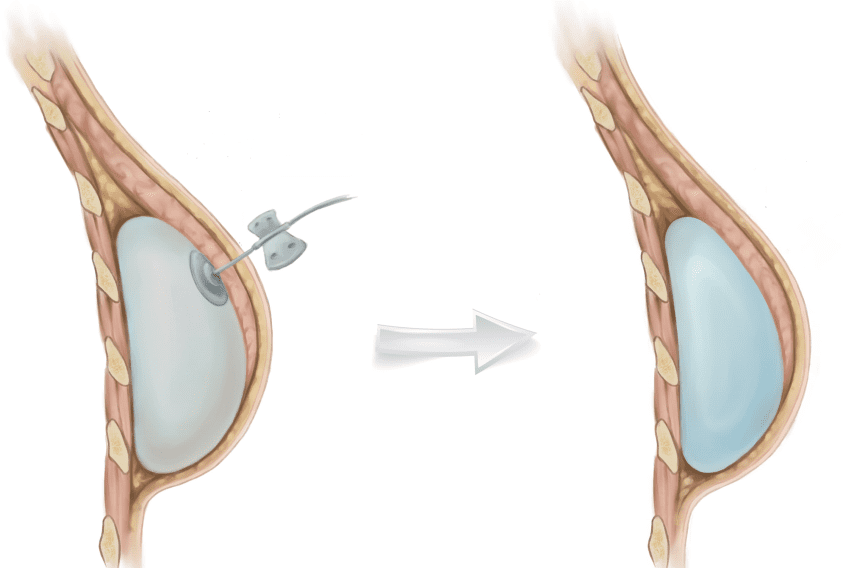
В случае, когда для установки постоянного имплантата нет достаточного укрытия мышцами и кожей выполняется двух-этапная реконструкция. При данном методе экспандер устанавливается для растяжения кожи и мышц грудной клетки на стороне мастэктомии, объем экспандера увеличивается путем заполнения его физраствором через клапанный механизм, помещенный рядом под кожу. После растяжения собственных мягких тканей на месте удаленной молочной железы устанавливается имплантат нужного объема и формы.
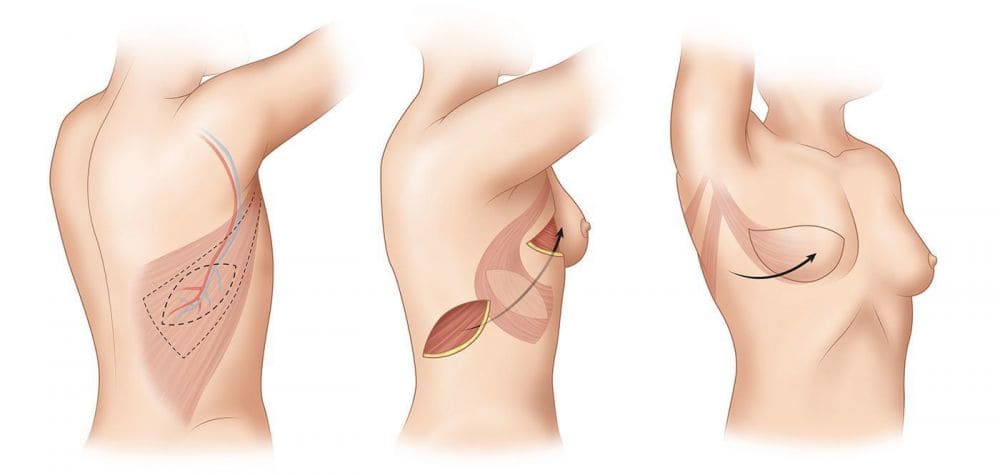
- Модифицированная мастэктомия по-Пейти или Маддену с одномоментной или отсроченной реконструкцией торакодорзальным лоскутом, при необходимости с одномоментной установкой силиконового импланта.


Торако-дорсальная область – заднее-боковая поверхность грудной стенки, откуда, в силу анатомических особенностей, без значительного косметического ущерба, возможно взятие лоскута и перемещение его на сосудах на место утраченной молочной железы. Разметка тканей производится таким образом, что послеоперационный рубец находится под бюстгальтером. Недостатком торакодорсального лоскута является недостаточный объем перемещаемых тканей, что часто требует дополнительной установки имплантата.
Недостатками методик с использованием эндопротезов являются значительное число осложнений, таких как капсулярная контрактура (20%) - соединительнотканная капсула, образующаяся вокруг имплантата, с последующей тенденцией к констрикции, образование складок (рипплинг) на поверхности железы (12%), формирование серомы (5%), инфекционные осложнения (5%), нередко требующие удаления имплантата, а также проблемы, связанные с имплантатами (10%), такие как разрывы, диффузия геля через оболочку, проблемы интегрированного или выносного порта экспандера и некоторые другие (Малыгин E.H., Братик A.B., Малыгин С.Е., 1998).
До настоящего времени не существует протеза, способного полностью исключить вышеописанные осложнения. Это связано с тем, что он не может не оказывать онкогенного действия, быть химически нейтральным, не меняться под действием температуры тела, не сморщиваться из-за прорастания соединительной ткани или под действием соединительно-тканной капсулы, физические свойства такого материала должны быть близки к свойствам жировой ткани, особенно в отношении веса, консистенции и эластичности [4].
- Мастэктомия с одномоментной или отсроченной реконструкцией поперечным ректоабдоминальным лоскутом, лоскутом Льюиса, лоскутом большой ягодичной мышцы, при необходимости с одномоментной установкой силиконового импланта.

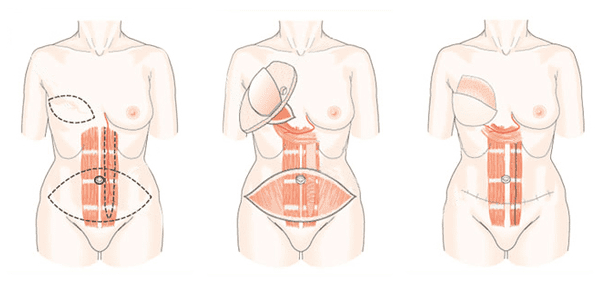
TRAM-лоскут (Transverse Rectus Abdominis Myocutaneous, поперечный лоскут прямой мышцы живота) считается на сегодняшний день одним из лучших методов реконструкции молочной железы. Кожа нижних отделов передней брюшной стенки идеально подходит по цвету и консистенции для восстановления молочной железы. Данная методика позволяет получить достаточный объем тканей и кожи. В донорской области выполняется абдоминопластика.
В случае восстановления молочной железы TRAM лоскутом возможно два варианта:его перемещение на прямой мышце живота, свободная пересадка с соединением сосудов с помощью микрохирургической техники.
Методика выполнения TRAM-пластики.
Из нижней части живота иссекается овальный лоскут, состоящий из кожи, фасций, жировой ткани и мышц. Этот лоскут через подкожный туннель проводится в область груди. Кровеносные сосуды находятся в толще прямой мышцы живота. Далее хирург придает тканям нужный вид и форму молочной железы и фиксирует швами на месте. При необходимости, с помощью микрохирургической техники выполняется так называемая «подкачка» - к сосудам лоскута подшиваются кровеносные сосуды для улучшения кровообращения.
Реконструкция молочных желез GAP-лоскутом (Gluteal Artery Perforator) Flap Breast Reconstruction.
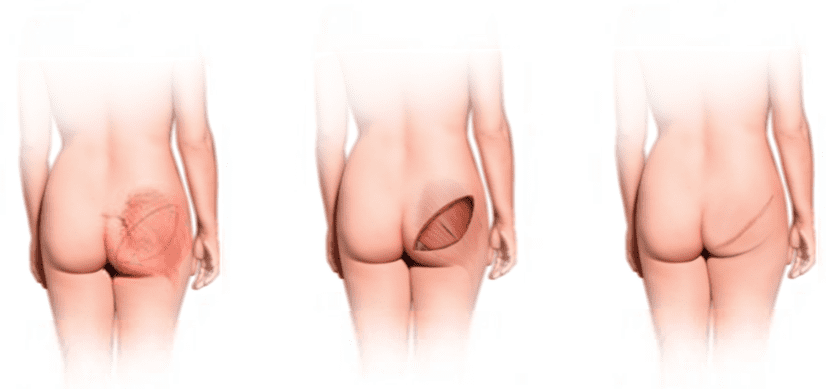
Область ягодиц – другой превосходный источник ткани в пластической хирургии, в том числе и при реконструкции груди. При этой операции с помощью овального разреза проводится иссечение лоскута с кожей, жировой клетчаткой и мышцей, который далее подшивается в области груди. Лоскуту придается форма молочной железы. В зависимости от желаемого размера груди дополнительно могут применяться имплантаты. Техника этой операции довольно сложна, так как для пересадки лоскута с ягодичной области на грудь приходится полностью пересекать все кровеносные сосуды, которые потом следует восстанавливать под микроскопом.
По нашему мнению одномоментные реконструкции молочной железы более предпочтительны, в связи с отсутствием стресса от многократных хирургических вмешательств и получением непосредственного результата. Длительное ожидание приемлемого эстетического результата приводит к дополнительным переживаниям у пациентов. В связи с этим снижается и качество их жизни. Кроме всего прочего возможность сохранения сосково-арреоллярного комплекса и инфрамаммарной складки позволяет добиваться наилучших косметических результатов. Вопрос о возможности одномоментной реконструкции молочной железы после мастэктомии зависит от стадии, прогноза и локализации опухолевого процесса, биологических свойств опухоли.
После проведения реконструктивно-пластических операций частота локальных рецидивов РМЖ не превышает таковую после мастэктомии. По данным Carlson G.W. с соавт. в течении 10 лет частота возникновения после мастэктомии и эндопротезирования местного рецидива при сохранении кожного лоскута составляет при I стадии 3.7%, II стадии – 9.8%.
Знание и умение применять полный спектр хирургических операций в реконструкции молочной железы позволяет индивидуально подобрать вариант радикального хирургического лечения в комбинации с реконструктивно-восстановительным этапом. Вышеописанные методики применимы не только у пациентов с раком молочной железы, но и для здоровых носителей наследственных мутаций, что несомненно улучшает не только продолжительность их жизни но и качество. Психологическая реабилитация женщин, перенесших лечение от рака молочной железы крайне важна. Поэтому применение реконструктивно-пластических операций после мастэктомии является необходимым компонентом в комбинированном лечении рака молочной железы при правильном отборе пациентов и сопоставлении всех показаний и противопоказаний для каждого конкретного случая. Соблюдение принципов онкологического радикализма необходимо сочетать с максимальным косметическим эффектом онко-пластической хирургии.
Список литературы
- Bermejo-Pérez M.J., Márquez-Calderón S., Llanos-Méndez A. Effectiveness ofpreventive interventions in BRCA1/2 gene mutation carriers: a systematic review // Int J Cancer. – 2007. – Vol. 121, № 2. – P. 225–31.
- Byrd L.M., Shenton A., Maher E.R., Woodward E., Belk R., Lim C., Lalloo F., Howell A., Jayson G.C., Evans G.D. Better life expectancy in women with BRCA2 compared with BRCA1 mutations is attributable to lower frequency and later onset of ovarian cancer // Cancer Epidemiol Biomarkers Prev. – 2008. – Vol. 17, № 6. – P. 1535–42.
- Chéreau E., Uzan C., Balleyguier C., Chevalier J., de Paillerets B.B., Caron O., Rimareix F., Mathieu M.C., Koskas M., Bourgier C., André F., Dromain C., Delaloge S. Characteristics, treatment, and outcome of breast cancers diagnosed in BRCA1 and BRCA2 gene mutation carriers in intensive screening programs including magnetic resonance imaging // Clin Breast Cancer. – 2010. – Vol. 10, № 2. – P. 113–8.
- Domchek S.M., Friebel T.M., Singer C.F., Evans D.G., Lynch H.T., Isaacs C., Garber J.E., Neuhausen S.L., Matloff E., Eeles R., Pichert G., Vant’veer L., Tung N., Weitzel J.N., Couch F.J., Rubinstein W.S., Ganz P.A., Daly M.B., Olopade O.I., Tomlinson G., Schildkraut J., Blum J.L., Rebbeck T.R. Association of risk-reducing surgery in BRCA1 or BRCA2mutation carriers with cancer risk and mortality // JAMA. – 2010. – Vol. 304, № 9. – P. 967–75.
- Evans A.J., Rakha E.A., Pinder S.E., Green A.R., Paish C., Ellis I.O. Basal phenotype: a powerful prognostic factor in small screen-detected invasive breast cancer with long-term follow-up // J Med Screen. – 2007. – Vol. 14, № 4. – P. 210–4.
- Evans D.G., Gaarenstroom K.N., Stirling D., Shenton A., Maehle L., Dørum A., Steel M., Lalloo F., Apold J., Porteous M.E., Vasen H.F., van Asperen C.J., Moller P. Screening for familial ovarian cancer: poor survival of BRCA1/2 related cancers // J Med Genet. – 2009. – Vol. 46, № 9. – P. 593-7.
- Evans D.G., Ingham S.L. Reduced life expectancy seen in hereditary diseases which predispose to early-onset tumors // Appl Clin Genet. – 2013. – Vol. 6. – P. 53–61.
- Finch A., Beiner M., Lubinski J., Lynch H.T., Moller P., Rosen B., Murphy J., Ghadirian P., Friedman E., Foulkes W.D., Kim-Sing C., Wagner T., Tung N., Couch F., Stoppa-Lyonnet D., Ainsworth P., Daly M., Pasini B., Gershoni-Baruch R., Eng C., Olopade O.I., McLennan J., Karlan B., Weitzel J., Sun P., Narod S.A.; Hereditary Ovarian Cancer Clinical Study Group. Salpingo-oophorectomy and the risk of ovarian, fallopian tube, and peritoneal cancers in women with a BRCA1 or BRCA2 Mutation // JAMA. – 2006. – Vol. 296, № 2. – P. 185–92.
- Finch A.P., Lubinski J., Møller P., Singer C.F., Karlan B., Senter L., Rosen B., Maehle L., Ghadirian P., Cybulski C., Huzarski T., Eisen A., Foulkes W.D., Kim-Sing C., Ainsworth P., Tung N., Lynch H.T., Neuhausen S., Metcalfe K.A., Thompson I., Murphy J., Sun P., Narod S.A. Impact of oophorectomy on cancer incidence and mortality in women with a BRCA1 or BRCA2 mutation // J Clin Oncol. – 2014. – Vol. 32, № 15. – P. 1547–53.
- Foulkes W.D., Grainge M.J., Rakha E.A., Green A.R., Ellis I.O. Tumor size is an unreliable predictor of prognosis in basal-like breast cancers and does not correlate closely with lymph node status // Breast Cancer Res Treat. – 2009. – Vol. 117, № 1. – P. 199–204.
- Gaarenstroom K.N., van der Hiel B., Tollenaar R.A., Vink G.R., Jansen F.W., van Asperen C.J., Kenter G.G. Efficacy of screening women at high risk of hereditary ovarian cancer: results of an 11-year cohort study // Int J Gynecol Cancer. – 2006. – Vol. 16, Suppl 1. – P. 54–9.
- Gadducci A., Sergiampietri C., Tana R. Alternatives to risk-reducing surgery for ovarian cancer // Ann Oncol. – 2013. – Vol. 24, Suppl 8. – P. viii47-viii53.
- Garber J.E., Offit K. Hereditary cancer predisposition syndromes // J Clin Oncol. – 2005. – Vol. 23, № 2. – P. 276–92.
- Gorodnova T.V., Sokolenko A.P., Ivantsov A.O., Iyevleva A.G., Suspitsin E.N., Aleksakhina S.N., Yanus G.A., Togo A.V., Maximov S.Y., Imyanitov E.N. High response rates to neoadjuvant platinum-based therapy in ovarian cancer patients carrying germ-line BRCA mutation // Cancer Lett. – 2015. – Vol. 369, № 2. – P. 363–7.
- Gronwald J., Robidoux A., Kim-Sing C., Tung N., Lynch H.T., Foulkes W.D., Manoukian S., Ainsworth P., Neuhausen S.L., Demsky R., Eisen A., Singer C.F., Saal H., Senter L., Eng C., Weitzel J., Moller P., Gilchrist D.M., Olopade O., Ginsburg O., Sun P., Huzarski T., Lubinski J., Narod S.A.; Hereditary Breast Cancer Clinical Study Group. Duration of tamoxifen use and the risk of contralateral breast cancer in BRCA1 and BRCA2 mutation carriers // Breast Cancer Res Treat. – 2014. – Vol. 146, № 2. – P. 421–7. Е.Н. Имянитов Т. 17, №4 – 2016 281
- Heemskerk-Gerritsen B.A., Menke-Pluijmers M.B., Jager A., Tilanus-Linthorst M.M., Koppert L.B., Obdeijn I.M., van Deurzen C.H., Collée J.M., Seynaeve C., Hooning M.J. Substantial breast cancer risk reduction and potential survival benefit after bilateral mastectomy when compared with surveillance in healthy BRCA1 and BRCA2 mutation carriers: a prospective analysis // Ann Oncol. – 2013. – Vol. 24, № 8. – P. 2029–35.
- Heijnsdijk E.A., Warner E., Gilbert F.J., Tilanus-Linthorst M.M., Evans G., Causer P.A., Eeles R.A., Kaas R., Draisma G., Ramsay E.A., Warren R.M., Hill K.A., Hoogerbrugge N., Wasser M.N., Bergers E., Oosterwijk J.C., Hooning M.J., Rutgers E.J., Klijn J.G., Plewes D.B., Leach M.O., de Koning H.J. Differences in natural history between breast cancers in BRCA1 and BRCA2 mutation carriers and effects of MRI screening-MRISC, MARIBS, and Canadian studies combined // Cancer Epidemiol Biomarkers Prev. – 2012. – Vol. 21, № 9. – P. 1458–68.
- Hermsen B.B., Olivier R.I., Verheijen R.H., van Beurden M., de Hullu J.A., Massuger L.F., Burger C.W., Brekelmans C.T., Mourits M.J., de Bock G.H., Gaarenstroom K.N., van Boven H.H., Mooij T.M., Rookus M.A. No efficacy of annual gynaecological screening in BRCA1/2 mutation carriers; an observational follow-up study // Br J Cancer. – 2007. – Vol. 96, № 9. – P. 1335–42.
- Ingham S.L., Sperrin M., Baildam A., Ross G.L., Clayton R., Lalloo F., Buchan I., Howell A., Evans D.G. Risk-reducing surgery increases survival in BRCA1/2 mutation carriers unaffected at time of family referral // Breast Cancer Res Treat. – 2013. – Vol. 142, № 3. – P. 611–8.
- Iyevleva A.G., Imyanitov E.N. Cytotoxic and targeted therapy for hereditary cancers // Hered Cancer Clin Pract. – 2016. – Vol. 14, № 1. – P. 17.
- Järvinen H.J., Renkonen-Sinisalo L., Aktán-Collán K., Peltomäki P., Aaltonen L.A., Mecklin J.P. Ten years after mutation testing for Lynch syndrome: cancer incidence and outcome in mutation-positive and mutation-negative family members // J Clin Oncol. – 2009. – Vol. 27, № 28. – P. 4793–7.
- Kotsopoulos J., Huzarski T., Gronwald J., Singer C.F., Moller P., Lynch H.T., Armel S., Karlan B., Foulkes W.D., Neuhausen S.L., Senter L., Tung N., Weitzel J.N., Eisen A., Metcalfe K., Eng C., Pal T., Evans G., Sun P., Lubinski J., Narod S.A.; Hereditary Breast Cancer Clinical Study Group. Bilateral Oophorectomy and Breast Cancer Risk in BRCA1 and BRCA2 Mutation Carriers // J Natl Cancer Inst. – 2016. – Vol. 109, № 1. pii: djw177.
- Kurian A.W., Sigal B.M., Plevritis S.K. Survival analysis of cancer risk reduction strategies for BRCA1/2 mutation carriers // J Clin Oncol. – 2010. – Vol. 28, № 2. – P. 222–31. Е.Н. Имянитов Т. 17, №4 – 2016 279
- Kurian A.W. BRCA1 and BRCA2 mutations across race and ethnicity: distribution and clinical implications // Curr Opin Obstet Gynecol. – 2010. – Vol. 22, № 1. – P. 72–8.
- Mai P.L., Malkin D., Garber J.E., Schiffman J.D., Weitzel J.N., Strong L.C., Wyss O., Locke L., Means V., Achatz M.I., Hainaut P., Frebourg T., Evans D.G., Bleiker E., Patenaude A., Schneider K., Wilfond B., Peters J.A., Hwang P.M., Ford J., Tabori U., Ognjanovic S., Dennis P.A., Wentzensen I.M., Greene M.H., Fraumeni J.F. Jr., Savage S.A. Li-Fraumeni syndrome: report of a clinical research workshop and creation of a research consortium // Cancer Genet. – 2012. – Vol. 205, № 10. – P. 479–87.
- Marchetti C., De Felice F., Palaia I., Perniola G., Musella A., Musio D., Muzii L., Tombolini V., Panici P.B. Risk-reducing salpingo-oophorectomy: a meta-analysis on impact on ovarian cancer risk and all cause mortality in BRCA 1 and BRCA 2 mutation carriers // BMC Womens Health. – 2014. – Vol. 14. – P. 150.
- Møller P., Stormorken A., Jonsrud C., Holmen M.M., Hagen A.I., Clark N., Vabø A., Sun P., Narod S.A., Mæhle L. Survival of patients with BRCA1-associated breast cancer diagnosed in an MRI-based surveillance program // Breast Cancer Res Treat. – 2013. – Vol. 139, № 1. – P. 155–61.
- Nelson H.D., Pappas M., Zakher B., Mitchell J.P., Okinaka-Hu L., Fu R. Risk assessment, genetic counseling, and genetic testing for BRCA-related cancer in women: a systematic review to update the U.S. Preventive Services Task Force recommendation // Ann Intern Med. – 2014. – Vol. 160, № 4. – P. 255–66.
- Satagopan J.M., Offit K., Foulkes W., Robson M.E., Wacholder S., Eng C.M., Karp S.E., Begg C.B. The lifetime risks of breast cancer in Ashkenazi Jewish carriers of BRCA1 and BRCA2 mutations // Cancer Epidemiol Biomarkers Prev. – 2001. – Vol. 10, № 5. – P. 467–73.
- Sokolenko A.P., Bogdanova N., Kluzniak W., Preobrazhenskaya E.V., Kuligina E.S., Iyevleva A.G., Aleksakhina S.N., Mitiushkina N.V., Gorodnova T.V., Bessonov A.A., Togo A.V., Lubiński J., Cybulski C., Jakubowska A., Dörk T., Imyanitov E.N. Double heterozygotes among breast cancer patients analyzed for BRCA1, CHEK2, ATM, NBN/NBS1, and BLM germ-line mutations // Breast Cancer Res Treat. – 2014. – Vol. 145, № 2. – P. 553–62.
- Sokolenko A.P., Mitiushkina N.V., Buslov K.G., Bit-Sava E.M., Iyevleva A.G., Chekmariova E.V., Kuligina E.Sh., Ulibina Y.M., Rozanov M.E., Suspitsin E.N., Matsko D.E., Chagunava O.L., Trofimov D.Y., Devilee P., Cornelisse C., Togo A.V., Semiglazov V.F., Imyanitov E.N. High frequency of BRCA1 5382insC mutation in Russian breast cancer patients // Eur J Cancer. – 2006. – Vol. 42, № 10. – P. 1380–4.
- Sokolenko A.P., Suspitsin E.N., Kuligina E.Sh., Bizin I.V., Frishman D., Imyanitov E.N. Identification of novel hereditary cancer genes by whole exome sequencing // Cancer Lett. – 2015. – Vol. 369, №2. – P. 274–88.
- Van der Velde N.M., Mourits M.J., Arts H.J., de Vries J., Leegte B.K., Dijkhuis G., Oosterwijk J.C., de Bock G.H. Time to stop ovarian cancer screening in BRCA1/2 mutation carriers? // Int J Cancer. – 2009. – Vol. 124, № 4. – P. 919–23.
- Yanus G.A., Belyaeva A.V., Ivantsov A.O., Kuligina E.Sh., Suspitsin E.N., Mitiushkina N.V., Aleksakhina S.N., Iyevleva A.G., Zaitseva O.A., Yatsuk O.S., Gorodnova T.V., Strelkova T.N., Efremova S.A., Lepenchuk A.Y., OchirGaryaev A.N., Paneyah M.B., Matsko D.E., Togo A.V., Imyanitov E.N. Pattern of clinically relevant mutations in consecutive series of Russian colorectal cancer patients. Med Oncol. – 2013 – Vol. 30, № 3 – P. 686.